Trioxyde d'hydrogène
| Trioxyde d'hydrogène | ||
 | ||
 | ||
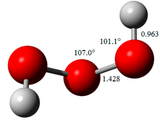
| Structure du trioxyde d'hydrogène | ||
| Identification | ||
|---|---|---|
| Synonymes | trioxydane | |
| No CAS | 14699-99-1[réf. nécessaire] | |
| PubChem | 166717 | |
| ChEBI | 46736 | |
| SMILES | OOO PubChem, vue 3D | |
| InChI | Std. InChI : vue 3D InChI=1S/H2O3/c1-3-2/h1-2H Std. InChIKey : JSPLKZUTYZBBKA-UHFFFAOYSA-N | |
| Propriétés chimiques | ||
| Formule | H2O3 [Isomères] | |
| Masse molaire[1] | 50,014 1 ± 0,001 g/mol H 4,03 %, O 95,97 %, | |
| Unités du SI et CNTP, sauf indication contraire. | ||
modifier  | ||
Le trioxyde d'hydrogène, ou trioxydane, est un composé chimique de formule H2O3. Instable, il est constitué d'une molécule linéaire HOOOH qui, en solution aqueuse, se décompose en eau H2O et en oxygène singulet 1O2 avec une demi-vie d'une vingtaine de millisecondes[2] :
- H2O3 → H2O + 1O2.
Décomposition
Sa décomposition est cependant plus lente en milieu anhydre, de l'ordre de 16 minutes dans des solvants organiques.

La production de trioxyde d'hydrogène à partir d'eau et d'oxygène singulet ne se produit pas naturellement, essentiellement en raison de l'extrême rareté de l'oxygène singulet. Cependant, on sait que l'ozone O3 dérive de l'oxygène singulet dans les systèmes biologiques, et on pense que du trioxyde d'hydrogène se forme au cours de cette réaction à partir de l'oxygène singulet[3].
Le trioxyde d'hydrogène est légèrement plus acide que le peroxyde d'hydrogène HOOH, se dissociant en ions HOOO− et H+[4]. La spectroscopie rotationnelle sur jets supersoniques a permis d'établir que sa molécule est linéaire en zigzag avec des liaisons O–O longues de 142,8 pm, plus courtes que celles de la molécule de peroxyde d'hydrogène HOOH (146,4 pm).
Préparation
Le trioxyde d'hydrogène peut être obtenu en petite quantité en faisant réagir de l'ozone avec du peroxyde d'hydrogène ou en réalisant une électrolyse de l'eau. Il est aussi produit en faisant réagir de l'ozone avec des agents réducteurs organiques comme dans le processus à anthraquinone (procédé à l'anthraquinone).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trioxydane » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Roald Hoffmann, « The Story of O – Burning Water », American Scientist, vol. 92, no 1, , p. 23 (lire en ligne) DOI 10.1511/2004.1.23
- ↑ (en) Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner et Paul Wentworth Jr., « Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone », Angewandte Chemie International Edition, vol. 43, no 35, , p. 4656-4659 (lire en ligne) DOI 10.1002/anie.200460457 PMID 15317003
- ↑ (en) Kohsuke Suma, Yoshihiro Sumiyoshi et Yasuki Endo, « The Rotational Spectrum and Structure of HOOOH », Journal of the American Chemical Society, vol. 127, no 43, , p. 14998-14999 (lire en ligne) DOI 10.1021/ja0556530 PMID 16248618
v · m | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hydrures alcalins (groupe 1) | |||||||||||||||||||||||||
| Hydrures alcalino-terreux (groupe 2) |
| ||||||||||||||||||||||||
| Hydrures du groupe 13 |
| ||||||||||||||||||||||||
| Hydrures du groupe 14 |
| ||||||||||||||||||||||||
| Hydrures de pnictogène (groupe 15) |
| ||||||||||||||||||||||||
| Chalcogénures d'hydrogène (groupe 16) |
| ||||||||||||||||||||||||
| Halogénures d'hydrogène (groupe 17) | |||||||||||||||||||||||||
| Hydrures de métal de transition |
| ||||||||||||||||||||||||
| Hydrures de lanthanide |
| ||||||||||||||||||||||||
| Hydrures d'actinide |
| ||||||||||||||||||||||||
| Exotiques |
| ||||||||||||||||||||||||
v · m | |
|---|---|
| États divers |
|
| État d'oxydation +1 |
|
| État d'oxydation +2 |
|
| État d'oxydation +3 |
|
| État d'oxydation +4 |
|
| État d'oxydation +5 |
|
| État d'oxydation +6 |
|
| État d'oxydation +7 |
|
| État d'oxydation +8 |
|
| Sujets connexes |
|
 Portail de la chimie
Portail de la chimie









